loading...
A. Metode Analisis Spektrometri Massa
Pada masa awal-awal perkembangan ilmu kimia, massa molekul suatu senyawa ditentukan dengan cara mengukur kerapatan uap atau penurunan titik beku senyawa tersebut, sementara rumus molekulnya ditentukan dengan cara analisis unsur. Metode ini membutuhkan waktu lama dan rumit, teknik ini juga memerlukan kuantitas sampel yang banyak dan dengan kemurnian yang tinggi. Saat ini berat molekul dan rumus molekul bisa ditentukan dengan cepat dan jumlah sampel sedikit menggunakan instrument yang dikenal dengan spektrofotometer massa (MS).Salah satu fungsi spektroskopi massa adaah identifikasi struktur kimia suatu molekul. Penentuan struktur molekul baik molekul organik maupun anorganik didasarkan pada pola fragmentasi dari ion-ion yang terbentuk ketika suatu molekul diionkan. Spektroskopi massa adalah suatu tekhnik analisis yang mendasarkan pemisahan bekas ion-ion yang sesuai dengan perbandingan massa dengan muatan dan pengukuran intensitas dari berkas ion-ion tersebut. Dalam spektroskopi massa, molekul–molekul senyawa organik ditembak dengan berkas elektron dan diubah menjadi ion-ion positif yang berenergi tinggi (ion - ion molekuler atau ion - ion induk), yang dapat dipecah-pecah menjadi ion-ion yang lebih kecil (ion- ion pecahan) atau fragmen. Lepasnya elektron dari molekul akan menghasilkan radikal kation. Pola fragmentasi suatu molekul sangat berbeda dengan molekul yang lain dan hasil analisisnya dapat berulang (reproducible).
M ➜ M+
Sebagai contoh, metanol memberikan ion molekul sebagai berikut: CH3-O-H ➜ CH3-O-H + 2e-1 m/z=32
Ion molekuler M+ selanjutnya terurai menjadi sepasang pecahan atau fragmen, yang dapat berupa radikal dan ion atau molekul kecil radikal.
M+ ➜ m1+ + m2
Ion-ion molekuler, ion-ion pecahan dan ion-ion radikal pecahan selanjutnya dipisahkan sesuai dengan massa dan muatannya oleh pembelokan medan magnet yang dapat berubah, dan akan menimbulkan arus pada kolektor yang sebanding dengan limpahan relatif molekul ion tersebut. Spektrum massa mengambarkan perbandingan limpahan relatif terhadap m/z (massa/muatan). Partikel-partikel netral yang dihasilkan dalam proses fragmentasi (m2) atau radikal (.m2) tidak dapat dideteksi dalam spektrometer massa. Spektrum massa akan menghasilkan puncak-puncak yang tercatat dalam rekorder, yang dipaparkan sebagai grafik batangan. Fragmen-fragmen disusun sedemikian sehingga peak-peak ditata menurut kenaikan m/z dari kiri ke kanan dalam spektrum. Intensitas peak sebanding dengan kelimpahan relatif fragmen-fragmen yang bergantung pada stabilitas relatif mereka. Puncak yang paling tinggi dinamakan base peak (puncak dasar) ditandai dengan nilai intensitas sebesar 100%; peak-peak yang lebih kecil misalnya 20%, 30%, adalah nilai relatif terhadap peak dasar. Puncak uang paling tinggi pada spektrum methanol adalah puncak M-1 pada m/z = 31. Puncak ini timbul karena lepasnya atom hidrogen dari ion molekul.
CH3-O-H ➜ CH2=O+-H + H m/z=31
B. Sejarah Spektrometri Massa
Pada tahun 1886, Eugen Goldstein mengamati sinar dari gas yang berpendar pada tekanan rendah ketika dialiri arus listrik yang berpindah dari anoda ke katoda. Sinar ini berbeda dengan arah muatan negatif sinar katoda (yang berpindah dari katoda ke anoda) sehingga Goldstein menyebutnya dengan muatan positif sinar anoda atau “kanalstraklen“, dalam bahasa inggris disebut ‘canal rays‘. Kemudian, Wilhelm Wien menemukan bahwa medan listrik dan medan magnet yang kuat membelokkan dapat membelokkan canal rays tersebut. Oleh karena itu pada tahun 1899, dikonstruksikanlah sebuah instrumen madan magnet dan medan listrik parallel yang dapat memisahkan sinar positif berdasarkan perbandingan muatan per massa (Q/M). Wien menemukan bahwa rasio muatan per massa bergantung pada sifat gas dalam tabung tidak bermuatan tersebut, keberhasilan pemisahan terebut digambarkan pada sebuah spectrograph massa atau spektroskopi massa.Aplikasi pertama dari spektrometri massa adalah untuk menganalis asam amino dan peptide di laporkan tahun 1958. Teknik modern dari spektrometri massa dikembangkan oleh Arthur Jeffrey Dempster dan F.W Aston pada tahun 1918 dan 1919. Tahun 1989 Hains Dehmelt dan Wilfgang Paul memperoleh nobel dalam bidang fisika untuk pengembangan instrument ini. Hadiah nobel dalam bidang kimia di peroleh John Bennett Fenn untuk pengembangan electrospray ionization (ESI) dan Koichi Tanaka untuk pengembangan Soft Laser Desorption (SLD) dan aplikasinya pada ionisasi makromolekul biologi seperti protein.
Kata spectrograph telah di gunakan sejak tahun 1884 sebagai “International Scientific Vocabulary“. Akar katanya adalah gabungan dari spektrum dan photo-graph-ic. Peralatan spektroskop di gunakan untuk mengukur rasio massa atau muatan disebut massa spektroskopi terdiri dari instrument yang dapat merekam nilai spectrum masa pada sebuah plat photographic.
Spektroskopi massa yang meggunakan layar phosphor dapat diganti dengan oscilloscope agar dapat memberikan penerangan secara langsung. Pengguanaan istilah spektroscopy massa tidak begitu cocok karena dapat salah arti jika dibandingkan dengan alat spectroscopy pada umumnya, oleh karena itu sekarang di gunakan istilah spektrometri massa yang di singkat mass-spsec (MS).
Setelah PD I berakhir, Aston kembali pada studinya di Cavendish, kini berfokus pada isotop. Pada 1919, Aston membuat sumbangan terpentingnya pada ilmu atom dengan penemuan spektograf massa. Alat itu bisa memisahkan isotop dengan mengukur perbedaan menit dalam massanya. Menggunakan spektograf massa, Aston berhasil mengenali 212 isotop yang ada. Penemuan juga mendorongnya merencanakan Aturan Bilangan Murninya yang terkenal yang menyatakan, "massa isotop oksigen yang ditetapkan, semua isotop lainnya memiliki massa yang hampir semuanya bilangan murni." Aturan itu penting untuk pengembangan ke depan pada teknologi energi atom. Untuk pencapaiannya dalam studi isotop unsur non-radioaktif menggunakan spektograf massa, Aston dianugerahi Penghargaan Nobel dalam Kimia pada 1922.
C. Bagian-Bagian Spektrometri Massa
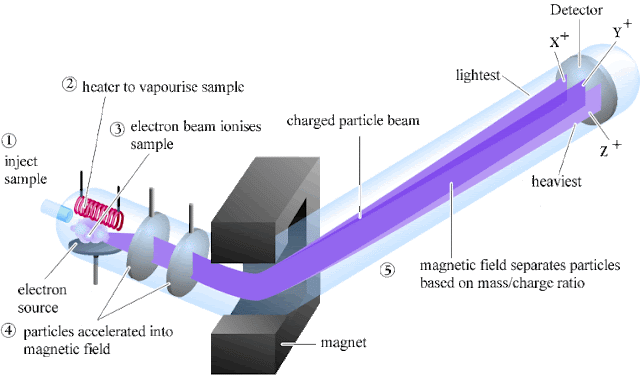
Secara umum spektroskopi massa terdiri dari tiga bagian penting, yaitu tempat pengionan sampel, pemisahan ion, dan deteksi ion yang terbentuk. Sampel dimasukan kedalam chamber, diuapkan dengan menaikkan temperatur chamber, ditembak dengan elektron berenergi tinggi, ion fragmen yang terbentuk dipercepat dan dipisahkan dalam medan magnet, kemudian dideteksi dengan detektor.Seiring dengan berkembangnya teknologi, masing-masing bagian telah mengalami perubahan untuk meningkatkan kemudahan dalam penggunaan dan kemampuan alat dalam menganalisa. Saat ini, spektroskopi massa biasanya digunakan secara mandiri dalam analisa sampel atau digunakan bersama-sama dengan alat lain, seperti dengan Kromatografi Cair Kinerja Tinggi (HPLC), Kromatografi Gas (GC), Electroforesis Kapiler (CE) sehingga dikenal istilah HPLC-MS, GC-MS, dan CE-MS. HPLC, GC, atau CE berperan untuk memisahkan campuran sampel, yang selanjutkan setiap komponen yang sudah terpisah akan dianalisa satu persatu dalam MS.
D. Pembentukan Ion pada Spektrometri Massa
Dalam spektrofometer massa reaksi pertama suatu molekul adalah ionisasi pelepasan sebuah elektron, yang menghasilkan ion molekul. Peak untuk radikal ion ini biasanya adalah peak paling kanan dalam spektrum, bobot molekul senyawa ini dapat ditentukan. Diduga bahwa elektron dalam orbital berenergi tinggi adalah elektron yang pertama-tama akan lepas. Jika sebuah molekul mempunyai elektron-elektron n menyendiri, maka salah satunya akan dilepaskan. Jika tidak terdapat elektron n, maka akan dilepaskan sebuah elektron pi. Jika tidak terdapat elektron n maupun elektron pi, maka ion molekul yang akan terbentuk sengan lepasnya sebuah elektron sigma.Setelah ionisasi awal ion molekul akan mengalami fragmentasi, yaitu proses pelepasan radikal-radikal bebas atau molekul netral kecil dilepaskan dari ion molekul itu. Sebuah ion molekul tidak pecah secara acak, melainkan cenderung membentuk fragmen-fragmen yang paling stabil. Marilah kita tinjau spektrum massa methanol. Spektrum ini terdiri dari tiga peak utama pada m/z = 29, 31, dan 32. Struktur fragmen sering dapat disimpulkan dari massa mereka. Peak M+ methanol (pada 32)
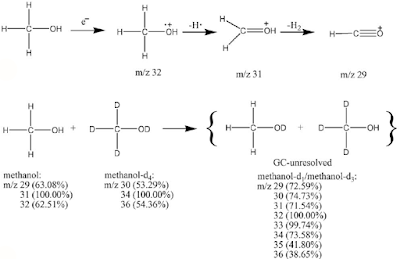 |
| Gambar 1. Proses Ionisasi Pada Metanol |
 |
| Gambar 2. Spektrum Massa Metanol |
D.1. Ion Metastabil
Dalam spektrum massa dapat terlihat adanya puncak-puncak lebar pada massa-massa yang tidak bulat seperti m/e 60,2 dan m/e 43,4 yang dikenal sebagai ion-ion metastabil, mereka mempunyai tenaga kinetik yang lebih rendah dari pada ion-ion normal dan timbul dari fragmentasi-fragmentasi yang terjadi selama lepas dari kamar pengion. Apabila sejumlah besar molekul M diubah menjadi ion-ion molekuler M+, maka tidak semua ion-ion tersebut akan memiliki tenaga eksitasi sama hingga beberapa akan mempunyai waktu hidup yang lebih panjang bila dibandingkan dengan yang lain. Ion-ion M+ dengan waktu hidup yang lebih pendek muingkin terurai dalam ruangan pengion menjadi ion-ion A+ dan radikal-radikal B, ion-ion A+ akan dideteksi oleh kolektor secara normal.Ion-ion molekuler yang lepas dari sumber ion akan dipercepat oleh tegangan pemercepat hingga memiliki tenaga translasi eV. Sejumlah ion-ion M ini dapat mencapai kolektor dan dideteksi. Meskipun demikian, jika ion-ion M lain terurai menjadi A+ dan B, segera setelah dipercepat, maka tenaga translasi induk M (eV) akan dibagikan antara A+ dan B sebanding dengan massa-massa mereka. Tenaga translasi ion A+ harus lebih rendah daripada induknya, dan ion A+ ini akan mencapai kolektor yang berbeda dari yang seharusnya (abnormal). Ion A+ dengan translasi yang abnormal tersebut dikenal sebagi ion metastabil. Massa ion metastabil A (m*) dapat dihitung dari massa ion induk (m1) dan ion anak normal A+ (m2) dengan persamaan sebagai berikut :
Persamaan tersebut sering memberikan hasil satuan massa 0,1 hingga 0,4 lebih rendah daripada massa kenyataannya yang diamati. Sebagi contoh, spectrum massa toluene menunjukkan puncak-puncak kuat pada m/z 91 dan m/z 65, bersama sama dengan puncak metastabil yang lebar dan kuat pada m/e 46,5. Dengan menggunakan persamaan perhitungan m* diperoleh 46,4, sehingga kita dapat mengintrepetasikan bahwa ion m/e 91 terurai dengan melepaskan 26 satuan massa menjadi ion m/e 65, dan ada sejumlah fragmen yang membentuk ion metastabil.
D.2. Efek Percabangan
Percabangan dalam suatu rantai hidrogen menghasilkan fragmentasi yang terjadi terutama pada cabang, karena radikal ion sekunder dan karbokation sekunder lebih stabil daripada bentuk primer. Stabilitas karbokation adalah faktor yang lebih penting daripada stabilitas radikal bebas. Misalnya ion molekul metilpropana menghasilkan suatu kation isopropil dan radikal metil.D.3. Efek suatu Heteroatom atau Gugus Karbonil
Perhatikan spektrum dari N-etilpropilamina yang terdapat pada gambar di bawah ini. Ion molekulnya mempunyai m/z 87. Fragmentasi ion molekul ini terjadi pada posisi alfa terhadap atom nitrogen dan menghasilkan fragmen dengan m/z 58 (kehilangan gugus etil) dan m/z 72 (kehilangan gugus metil). Tipe fragmentasi seperti ini disebut pembelaan -α dan lazim terjadi dalam amina maupun eter.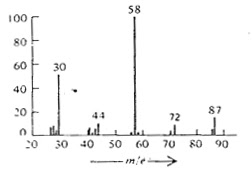 |
| Gambar 3. Spektrum Massa n-etilpropilamina |
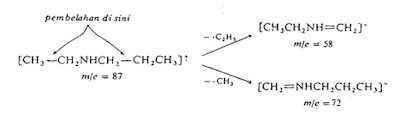 |
| Gambar 4. Pemutusan Ikatan dan pembentukan fragmen pada n-etilpropilamina |
Faktor penyebab pembelahan ini adalah bahwa kation yang dibentuk dalam reaksi ini terstabilkan oleh resonansi. Fragmentasi serupa terjadi pada suatu ikatan di dekat suatu gugus karbonil (atau α terhadap oksigen). Hal ini kation yang dihasilkan juga terstabilkan oleh resonansi.
D.4. Pelepasan Molekul Kecil
Molekul-molekul kecil yang stabil seperti H2O, CO2, CO dan C dapat terlepas dari dalam sebuah ion molekul. Misalnya sebuah alkohol mudah kehilangan H2O dan menunjukkan suatu peak yang 18 satuan massa lebih kecil daripada peak ion molekul itu. Peak ini dikatakan sebagai peak M-18. dalam banyak alkohol, eleminasi H2O sedemikian mudah sehingga peak ion molekul itu bahkan tidak dijumpai dalam spektrum. Sebagai contoh spektrum 1-butanol yang dapat dilihat pada gambar di bawah ini, merupakan spektrum massa yang khas dari suatu alkohol. |
| Gambar 5. Fragmen Massa - Pelepasan Molekul Kecil |
D.5. Penataan Ulang Mc Lafferty
Penataan ulang Mc Lafferty terjadi bila terdapat sebuah atom hidrogen γ terhadap suatu gugus karbonil dalam ion molekul itu. Perhatikan gambar fragmentasi dari butanaldehida: |
| Gambar 6. Penataan ulang Mc Lafferty pada ion butanaldehida |
Sampel yang akan dianalisis dimasukkan pada tempat pengionan di bagian pertama dari alat spektroskopi massa. Sampel dapat berupa gas, padatan, dan larutan sesuai dengan wujud sampel dan teknik ionisasi yang dipilih. Beberapa teknik ionisasi yang sering digunakan di antaranya adalah:
1. Tumbukan Elektron (Electron Impact/EI)
Dalam ruang pengionan, uap sampel ditumbuk dengan elektron berenergi tinggi yakni sebesar 70 ev. Energi yang diserap molekul sampel akan mendorong pengionan atau pelepasan elektron dari orbital ikatan dan orbital anti-ikatan. Energi ditransfer kearah pembentukan ion melalui proses tumbukan seperti terlihat pada persamaan reaksi berikut :A-B-C + e- → A-B-C+ + 2 e-
Metode ini banyak digunakan untuk sampel yang volatil dan stabil pada temperatur tinggi. Sacara umum, lebih umum digunakan spektroskopi massa dengan metode tumbukan elektron yang menghasilkan kation (ion positif) dari pada yang menghasilkan anion (ion negatif). Selain itu, telah banyak dipublikasikan referensi atau literatur dengan pola-pola fragmentasi ion positif dibandingkan ion negatif.
2. Electrospray Ionisation (ESI)
Suatu larutan disemprotkan melalui pipa berdiameter sangat kecil kedalam ruang vakum dengan medan listrik bergradient beberapa ratus hingga ribuan volt per centimeter, menghasilkan ion gas dari zat terlarut. ESI merupakan teknik MS yang mampu menghasilkan fraksi besar dari fragmen-fragmen molekul organik atau analit biologis.Karena MS mengukur rasio massa terhadap muatan ion, metode ini memberikan keuntungan dalam menganalisa massa yang sangat tinggi tanpa perlu instrument analisis massa yang khusus. Sebagai contoh, suatu ion dengan massa 120.000 dalton membawa 60 muatan positif muncul pada 2000 m/z. Metode ini telah digunakan untuk mengukur massa ion dari molekul hingga 200.000 dalton, seperti protein.
3. Chemical Ionization (CI)
Ion yang akan dianalisa diproduksi melalui transfer suatu partikel (H+, H-, dan lebih berat) hasil pengionan suatu reaktan berupa gas yang lebih berat ke dalam sampel. Umumnya reaktan yang digunakan adalah gas metana (CH4) pada tekanan 0,2-2,0 torr (27-270 pascal). Mula-mula metana diionkan melalui proses tumbukan elektron menghasilkan ion CH4+ . Selanjutnya ion tersebut bereaksi dengan molekul netral metana yang lain menghasilkan asam Bronsted yang kuat untuk bereaksi dengan molekul sampel melalui transfer proton.CH4 + e- → CH4+ + 2e-
CH4+ + CH4 → CH5+ + CH3
CH3+ + CH4 → C2H5+ + H2
CH5+ + A-B-C → HABC+ + CH4
C2H5+ + A-B-C → HABC+ + C2H4
Gas lain yang juga sering digunakan adalah hidrogen (H2), uap air (H2O), ammonia (NH3), dan isobutana (C4H10). Dalam gas-gas ini, ion yang reaktif adalah H3+, H2O+, NH3+ dan C4H10+. Energi yang ditransfer pada proses ionisasi dengan metode ini berkisar 10-50 kkal/mol atau 40-200 kJ/mol, jumlah energi yang cukup kuat untuk proses fragmentasi, namun fragmentasi yang terjadi lebih sedikit dari metode tumbukan elektron.
4. Fast Atom Bombardment (FAB)
FAB merupakan suatu tehnik ionisasi yang popular untuk molekul non-volatil dan atau labil terhadap temperatur tinggi. Baik digunakan untuk molekul polar dan molekul dengan berat molekul tinggi. Umumnya FAB menggunakan uap atom netral berkecepatan tinggi seperti Argon dan Xenon pada 8 kV. Sampel yang dianalisa dapat berupa padatan atau sampel yang dilarutkan dalam pelarut kental seperti gliserol. Biasanya ion pseudo molekuler [M+H]+ terbentuk bersama sedikit ion fragmen dengan massa yang lebih rendah.5. Field Desorption (FD)
Untuk material yang kurang volatil, ionisasi biasanya dilakukan dekat permukaan elektroda melalui gradient medan listrik yang sangat tinggi (beberapa volt per angstrom). Awan elektron dalam molekul didistorsi dan bagian molekul yang mengandung kelebihan elektron berperan sebagai anoda. Ion yang terbentuk akan ditolak oleh anoda. Lifetime dari ion ini sangat singkat dibandingkan dengan ion hasil tumbukan electron. Karena sedikit energi yang ditransfer berupa energi dalam dan ion bergerak sangat cepat, dan fragmentasinya sangat sedikit, maka berat molekul sangat mudah dideteksi.6. Matrix Assisted Laser Desorption Ionization (MALDI)
Metode ini baik digunakan untuk sampel dengan berat molekul lebih besar dari 700.000, dan tehnik ini telah digunakan untuk menentukan berat molekul dari molekul biologi besar yang bersifat polar, seperti enzim, analisa interaksi antibodi. Sampel berupa matriks organik atau dibuat dalam matrik organic (asam sinapinat biasanya untuk sampel protein), dioleskan pada permukaan suatu lempeng, selanjutnya diradiasi dengan sinar laser (N2 337 nm). MALDI adalah metode ionisasi yang lemah dan fragmentasi ion sampel jarang terjadi. Ion yang dihasilkan biasanya berupa ion molekuler sehingga spektra yang dihasilkan sangat sederhana. MALDI-TOF adalah instrumen pengembangan dari spectrometer massaE. Analisis Spektra Massa
Peralatan spektroskopi massa resolusi tinggi atau high resolution mass spectrometry (HRMS) yang tersedia saat ini secara akurat dapat menentukan massa suatu ion molekuler atau massa yang setara dengan rumus molekul, fragmen molekul (pecahan molekul setelah proses ionisasi), sehingga memudahkan untuk membedakan ion molekuler atau fragmen molekul yang perbedaan massanya sangat kecil. Massa yang teramati adalah penjumlahan eksak semua massa atom penyusun molekul atau fragmen molekul dengan kelimpahan isotop terbanyak. Sebagai contoh, HRMS mampu membedakan molekul CO, N2, CH2N, dan C2H4 dengan sangat akurat. Perhatikan massa dari masing-masing molekul tersebut. CO bermassa 27,9949, N2 bermassa 28,0062, CH2N bermassa 28,0187, dan C2H4 bermassa 28,0312.Untuk ion molekul yang tersusun oleh atom-atom yang memiliki beberapa isotop atom dengan kelimpahan yang cukup besar, maka ion molekul yang muncul bisa lebih dari satu. Ion molekuler yang muncul biasanya ditandai sebagai M+, [M+1]+, [M+2]+, dan seterusnya tergantung jumlah ion molekuler yang mungkin ada. Sebagai contoh CH3Br yang memiliki ion molekuler M+ dengan mass 93.9417 dan [M+2]+ dengan mass 95.9397 sebagai akibat adanya isotop 79Br dan 81Br yang kelimpahannya hampir sama banyak jumlahnya.
Bila ion molekuler diketahui, maka rumus molekul dari sampel dapat ditentukan pula dengan cara mencocokkan harga m/z dari ion molekuler dengan tabel Rumus Molekul dengan variasi jumlah karbon, hidrogen, nitrogen, dan oksigen yang tersedia. Selanjutnya dari rumus molekul yang ada, dapat dihitung indeks kekurangan hidrogen (sering disebut BDE) yang bermanfaat untuk diprediksi jumlah ikatan rangkap atau adanya cincin/siklik dalam molekul tersebut. Harga DBE dihitung dengan rumus :
DBE = C - ½ H - ½ Halogen + ½ N + 1
Adanya isotop suatu atom dapat membantu dalam identifikasi suatu molekul. Spektra massa suatu senyawa akan menampilkan puncak yang menginformasikan jumlah isotop yang ada dalam molekul. Sebagai contoh spektra massa suatu hidrokarbon yang memiliki 5 atom karbon. Intensitas puncak [M+1]+ yang mengindikasikan banyaknya isotop C13 dalam molakul, pasti 5(1,1%) = 5(0,011) dikalikan intensitas relatif puncak ion molekuler. Jadi banyaknya atom karbon dalam molekul dapat dihitung bila intensitas relatif [M]+ dan [M+1]+ diketahui.
Baca juga artikel menarik kami lainnya:
Kromatografi, jenis-jenis dan cara kerja kromatografi
Gerhana Matahari Total, Sebagian dan Cincin. Penjelasan Lengkap
Spektroskopi, Cahaya sebagai gelombang elektromagnetik
loading...



0 Response to "Spektrometri Massa"
Posting Komentar